
电池反应都是自发进行的氧化还原反应。因此电池反应的方向即氧化还原反应自发进行的方向。判断氧化还原反应进行的方向时,可将反应拆为两个半反应,求出电极电位。然后根据电位高的为正极起还原反应,电位低的为负极起氧化反应的原则,就可以确定反应自发进行的方向。如果两个电对的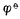 值相差较大(即Eφ),浓度的变化对电位的影响不大,不致于使反应改变方向。因此,当Eφ<0.2V 时,即使不处于标准状态,也可直接用
值相差较大(即Eφ),浓度的变化对电位的影响不大,不致于使反应改变方向。因此,当Eφ<0.2V 时,即使不处于标准状态,也可直接用 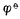 值的大小确定反应方向。否则,必须考虑浓度和酸度的影响,用能斯特方程式计算出电对的
值的大小确定反应方向。否则,必须考虑浓度和酸度的影响,用能斯特方程式计算出电对的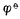 值,用E>0作为判断确定反应进行的方向,若E>0,正向反应能自发进行;E<0,正向反应不能自发进行,其逆向反应能自发进行。
值,用E>0作为判断确定反应进行的方向,若E>0,正向反应能自发进行;E<0,正向反应不能自发进行,其逆向反应能自发进行。
例9 判断298K时下列反应进行的方向:
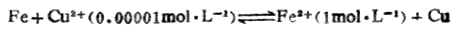
解:将上述反应写成两个半反应,并查出它们的标准电极是位:

标准电动势为:Eφ=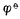 2-
2-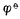 1=0.4402-(-0.4402)
1=0.4402-(-0.4402)
=0.7804(V)。
因为Eφ<0.2V,可直接用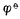 值判断反应进行的方向。
值判断反应进行的方向。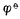 2>
2>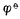 1,表明Cu2+是比Fe2+更强的氧化剂,Fe是比Cu更强的还原剂所以上述反应可自发地向右进行。
1,表明Cu2+是比Fe2+更强的氧化剂,Fe是比Cu更强的还原剂所以上述反应可自发地向右进行。
为了证明这个结论的正确性,我们可以按非标准态的电池反应计算电动势。

电池电动势为:E=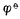 2-
2-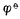 1=0.1923-(-0.4402)
1=0.1923-(-0.4402)
=0.6325(V)
因为E<0,上述反应可自发地向右进行。
例10 判断298K时反应

当[HAsO2]=[H3AsO4]=1mol.L-1,[I-]=1mol.L-1,在中性和酸性([H+]=1mol.L-1)溶液中反应进行的方向。
解:将上述反应写成两个半反应,并查出它们的标准电极电位:

在中性溶液中,[H+]=1.0*10-71mol.L-1。
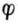 1=
1=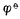 1=+0.535V
1=+0.535V
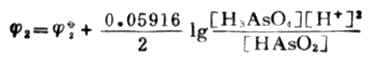
=0.559+0.059161g[H+]
=0.559+0.059161g10-7
=0.559+0.414
=0.145(V)
因为 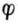 1
1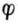 2,所以I2是比H3AsO4更强的氧化剂,而HAsO2是比I-更强的还原
2,所以I2是比H3AsO4更强的氧化剂,而HAsO2是比I-更强的还原
剂。因而上述反应能自发地向右进行。即
HAsO2+I2+2H2O→H3AsO4+2I-+2H+
当溶液中氢离子浓度为1mol.L-1时,
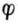 1=
1=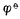 1=+0.535V
1=+0.535V
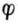 2=
2=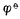 2=+0.559V
2=+0.559V
因为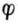 1<
1<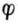 2,所以H3AsO4是比I2更强的氧化剂,而I-更强的还原剂。因而上
2,所以H3AsO4是比I2更强的氧化剂,而I-更强的还原剂。因而上
述反应能自发地向右进行。即
H3AsO4+2I-+2H+→HAsO2+I2+2H2O